Tutaj zostanie pokrótce przedstawione funkcjonowanie gruczołu tarczowego w warunkach zdrowia oraz najczęściej spotykanych schorzeń tego gruczołu.
Prawidłowe funkcjonowanie tarczycy
Podstawowym zadaniem gruczołu tarczowego jest produkcja hormonów tarczycowych - tyroksyny (oznacznej T4) oraz, w mniejszej ilości, trójjodotyroniny (oznacznej T3). Hormony te są odpowiedzialne za wiele procesów związanych z przemianą materii, więc zaburzenia ich produkcji
Uwagi morfologiczne
Tarczyca (łac.: glandula thyroidea, ang.: thyroid gland) położona jest w przedniej części szyi, przed krtanią (chrząstką tarczową). Podzielona jest na dwa płaty (prawy i lewy) połączone cieśnią, czasami posiada również położony do góry od nich płat piramidalny. U dorosłego człowieka objętość tego gruczołu (suma objętości obu płatów) nie przekracza 25 ml (u mężczyzn) lub 18 ml (u kobiet). Ultrasonograficznie przedstawia się jako organ o dość równomiernej, podobnej do ślinianek, echogeniczności.
Miąższ tarczycy zbudowany jest z pęcherzyków tarczycowych - są to małe owalne twory, których ścianka wyścielona jest warstwą komórek tarczycowych (tyreocytów). W środku pęcherzyka tarczycowego zgromadzony jest koloid zawierający m.in. tyreoglobulinę (Tg) i peroksydazę tarczycową (TPO). Oba z wymienionych białek są produkowane przez tyreocyty, pierwsze z nich służy jako "tworzywo" do wytwarzania hormonów, drugie jest enzymem katalizującym ten proces. W sąsiedztwie pęcherzyków znajdują się pojedyncze komórki przypęcherzykowe produkujące inny hormon - kalcytoninę, której znaczenie u człowieka wydaje się być jednak drugorzędne.
Oś hormonalna podwzgórze-przysadka-tarczyca
Funkcja tarczycy regulowana jest przez "organy nadzorujące": podwzgórze (część mózgowia) i przysadkę. Podwzgórze produkuje oligopeptyd TRH (tyreoliberyna, ang.: thyrotropin releasing hormone), którą wydziela do naczyń krwionośnych układu wrotnego podwzgórzowo-przysadkowego. Praktycznie cała krew zawierająca TRH trafia do przysadki, tylko bardzo niewielka ilość TRH dostaje się do krążenia ogólnego. TRH pobudza komórki przedniego płata przysadki mózgowej do produkcji TSH (tyreotropina, ang.: thyroid-stimulating hormone), która trafia do krążenia ogólnego. TSH składa się z podjednostki α i β - pierwsza z nich jest wspólna dla kilku innych hormonów przysadki (LH i FSH) oraz hCG (ludzkiej gonadotropiny kosmówkowej - "hormonu ciążowego"), druga jest strukturalnie nieco podobna do hCG. Stąd wynikać mogą czasami problemy
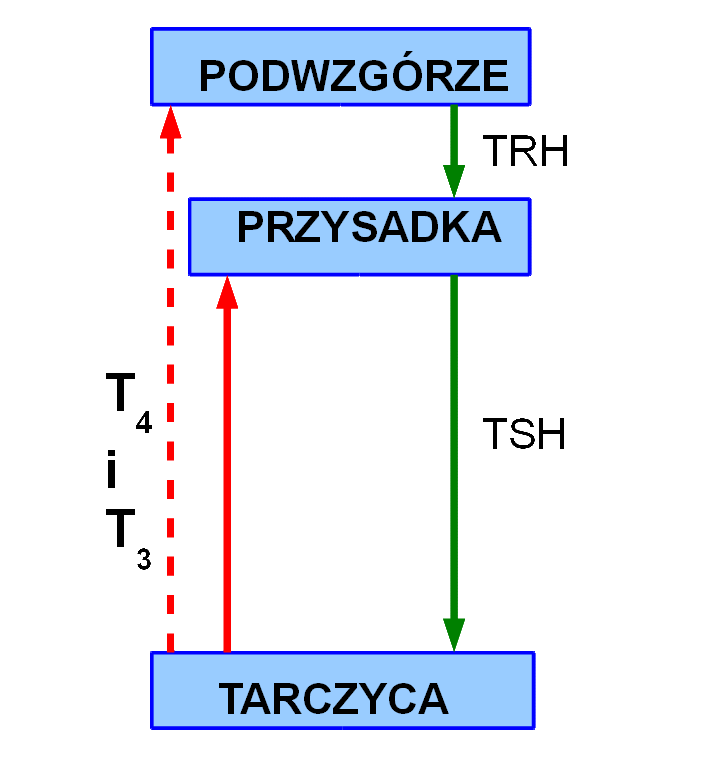
Schemat osi podwzgórze-przysadka-tarczyca. Kolorem zielonym zaznaczono oddziaływanie stymulujące, czerwonym zaś - hamujące.
Właściwym hormonem tarczycy jest tyroksyna (czterojodotyronina, T4). Z niej powstaje (patrz niżej) trójjodotyronina (T3). Hormony te działają
Produkcja hormonów tarczycowych, rola jodu
Do syntezy hormonów tarczycowych (głównie T4, ale także T3) potrzebny jest jod. W postaci anionu jodkowego (I-) dostarczany jest on
Następnie z krwi aniony jodkowe transportowane są do tyreocytów (komórek wyścielających pęcherzyki tarczycowe). Odpowiedzialny za transport jest symporter sodowo-jodkowy (NIS, hNIS), który przenosi anion jodkowy do komórki razem z dwoma kationami sodowymi, niskie stężenie jonów sodowych w komórce utrzymywane jest za pomocą pompy sodowo-potasowej. Istnieją substancje, które selektywnie blokują NIS. Należą do nich przede wszystkim nadchlorany (ClO4-) i rodanki (SCN-, zawarte w niektórych roślinach). Stężenie jodków w cytoplazmie tyreocytów jest wyższe niż we krwi kilkadziesiąt razy, w sytuacji niedoboru jodu - nawet pięćset razy. Z tyreocytu aniony jodkowe są dalej transportowane do światła pęcherzyka - za tę funkcję odpowiedzialne jest białko pendryna (ang.: pendrin).
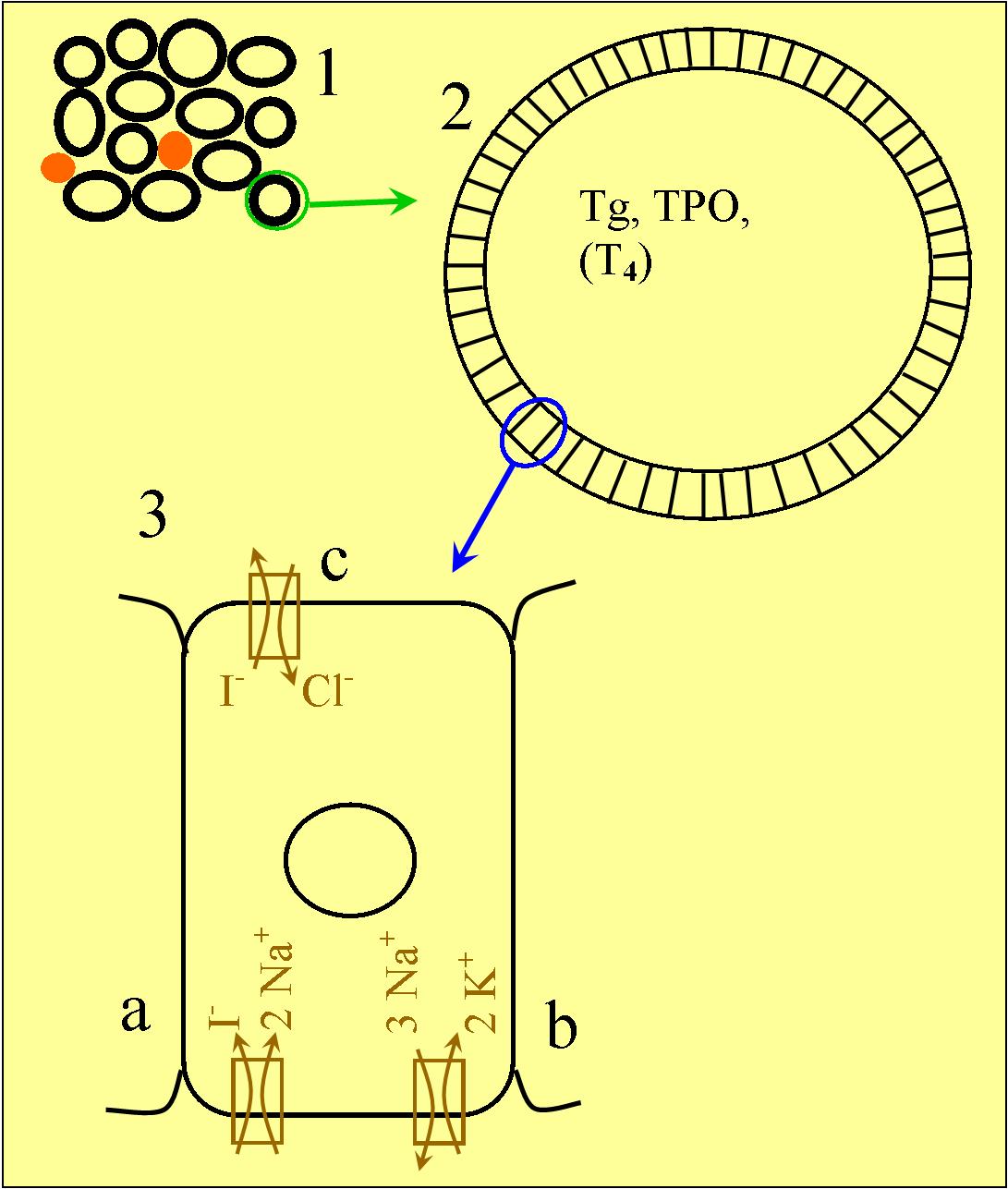
Organizacja funkcjonalna tarczycy i transport jodu:
1. Schematyczne przedstawienie fragmentu tkanki tarzycowej; widoczne są pęcherzyki i naczynia krwionośne;
2. Powiększony pęcherzyk tarczycowy; ma on kształt owalu, którego ściany wyścielone są warstwą komórek tarczycowych (tyreocytów), a światło wypełnione jest koloidem (zawierającym tyreoglobulinę - Tg, a także peroksydazę tarczycową - TPO);
3. Jeszcze bardziej powiększony tyreocyt; transport jodu (w postaci anionów jodkowych) odbywa się w kierunku od zewnątrz do środka pęcherzyka tarczycowego.
a. Symporter sodowo-jodkowy (NIS): transportujący do komórki anion jodkowy razem z dwoma kationami sodowymi;
b. Pompa sodowo-potasowa: energochłonny transporter wymieniający trzy kationy sodowe (usuwa je z komórki) na dwa kationy potasowe (wciąga je do komórki);
c. Pendryna: antyporter transportujący anion jodkowy z tyreocytu do pęcherzyka tarczycowego (wymienia go na anion chlorkowy).
Dalej, w pęcherzyku jodek ulega utlenieniu do wolnego jodu (I) oraz prawdopodobnie do kationu jodowego (I+, ang.: iodinium cation). W procesie tym bierze udział peroksydaza tarczycowa (thyroid peroxidase, TPO), produktem pośrednim jest nadtlenek wodoru (H2O2). W tej formie jod wbudowywany jest
Tyroksyna (T4) jest głównym hormonem tarczycy. Przekształcenie jej w bardziej aktywną biologicznie trójjodotyroninę (T3) odbywa się głównie

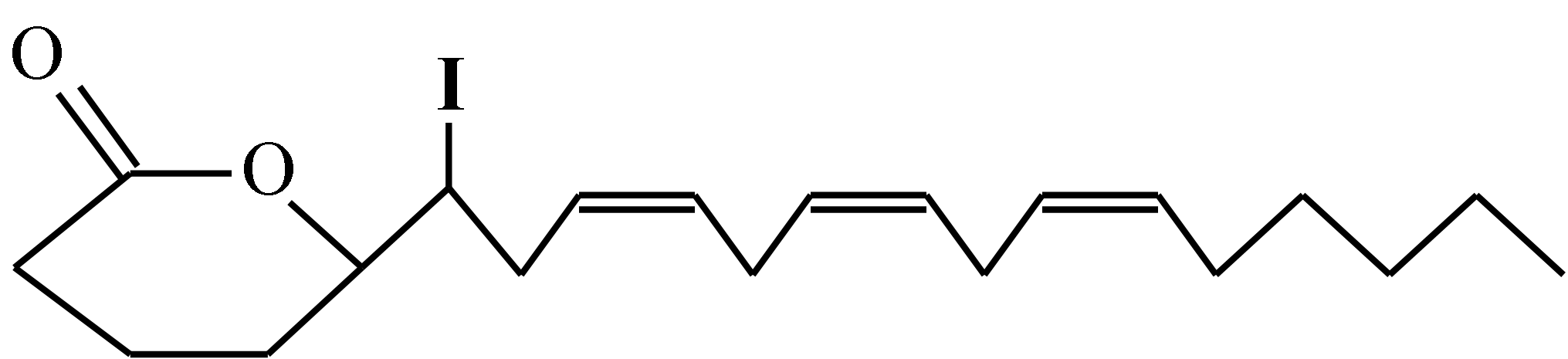
Struktura chemiczna tyroksyny (T4) - kolorem czerwonym oznaczono jod w pozycji 5'. Trójjodotyronina (T3) jest tego atomu jodu pozbawiona.
Utleniony jod, oprócz powyżej omówionych szlaków bezpośrednio związanych z produkcją hormonów, bierze udział w syntezie związków jodolipidowych. Odgrywają one ważną rolę regulacyjną w niektórych procesach metabolicznych gruczołu tarczowego oraz poza nim.
Dalsze losy T4 i T3
Tyroksyna krąży we krwi w postaci związanej w ponad
fT4: 11,50-23,20 pmol/l,
fT3: 3,50-6,50 pmol/l.
Znaczne związanie z białkami sprawia, że T4 i T3 posiadają długie biologiczne czasy połowicznych zaników we krwi. Czasy te wynoszą odpowiednio
T4 oraz, przede wszystkim, T3 oddziałują na komórki docelowe poprzez łączenie się z receptorami jądrowymi, wpływając na ekspresję genów
Inne szlaki metaboliczne jodu
Jod nie tylko bierze udział w syntezie hormonów tarczycy, ale odgrywa także inne ważne role. Jod w postaci utlenionej wchodzi w reakcję ze związkami tłuszczowymi (lipidowymi) obecnymi w błonie komórkowej, tworząc związki jodolipidowe. Spośród kilku zidentyfikowanych produków tych reakcji najważniejsze są δ-lakton kwasu 6-jodo-5-hydroksy-eikozanotrienowego (ang.: 6-iodo-5-hydroxy-eicosatrienoic acid δ-lactone, 6-IL) oraz 2-jodoheksadekanal (aldehyd α-jodo-palmitynowy, ang.: 2-iodohexadecanal, 2-IHDA).
 |
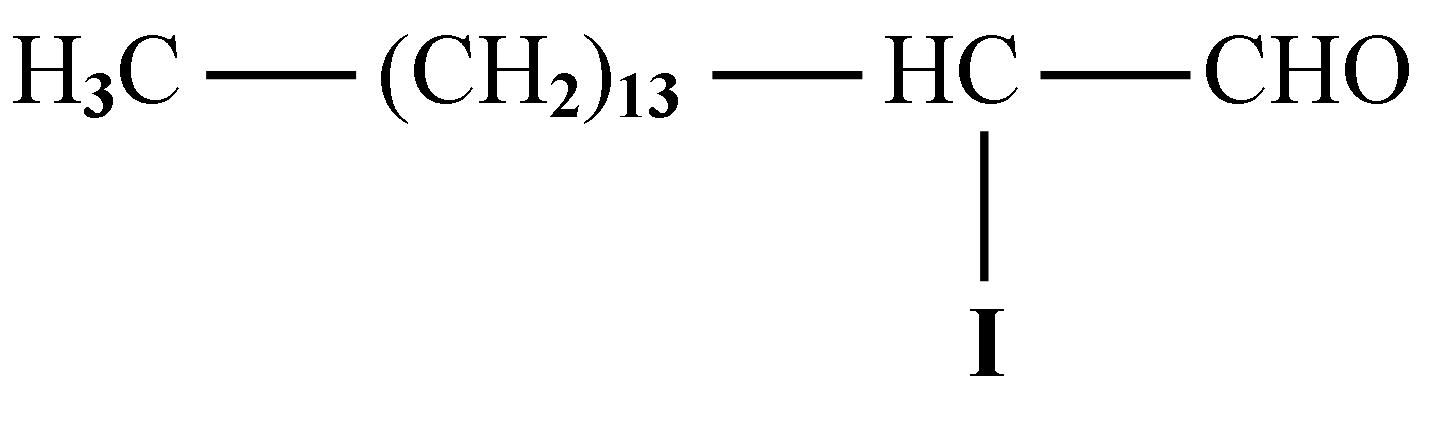 |
6-IL oddziałuje na komórki w złożony sposób. Może blokować działanie kinazy białkowej C, wpływać na transdukcję sygnałów niektórych czynników wzrostu oraz, poprzez łączenie z peroksysomami, regulować działanie ich receptorów. Nie wykazano wpływu 6-IL na poziom cAMP w komórkach. Substancja ta hamuje wzrost, a nawet może wywoływać ograniczoną apoptozę (programowane "samobójstwo" komórek) tyreocytów. Udowodniono w warunkach doświadczalnych także jej hamujący wpływ na wzrost pewnych nowotworów.
2-IHDA charakteryzuje się długim czasem metabolizmu w komórce. Mechanizm działania tej substancji polega na obniżaniu stężenia cAMP w cytoplazmie. Powoduje to spowolnienie metabolizowania jodu w tarczycy. Efektem jest działanie hamujące wzrost wola oraz wywoływanie efektu Wolffa-Chaikoffa (zablokowanie tarczycy po ekspozycji na dużą ilość jodu).
Badania epidemiologiczne potwierdzają zależność występowania pewnych chorób od zaopatrzenia organizmu w jod. W regionach niedoboru jodu choroby łagodne tarczycy (takie jak wole i autonomia) występują znacznie częściej. Poza tym zaobserwowano w tych regionach także częstszą zachorowalność na nowotwory złośliwe m.in. żołądka i sutka (te narządy posiadają enzym peroksydazę, konieczny do utlenienia jodu i dalszych jego przekształceń). Co ciekawe, nie wykazano znaczącej korelacji między występowaniem niedoboru jodu a częstością raka tarczycy, jednak w sytuacjach niedoboru zaobserwowano wyższą częstość gorzej rokującego raka pęcherzykowego i źle rokującego raka anaplastycznego w stosunku do najlepiej rokującego raka brodawkowego.
Tarczyca a nadmiar jodu
Zdrowa tarczyca wyposażona jest w mechanizmy ochronne zabezpieczające nasz organizm przed nadmiernym wydzielaniem hormonów
Pacjent z tarczycą ze skłonnością do nadczynności nie może być narażany na kontaminację jodem! U takiego chorego nadmiar jodu spowodować może takie wystąpienie/nasilenie nadczynności, które będzie zagrażało nawet jego życiu. Dodatkowo mające miejsce zablokowanie tarczycy uniemożliwi jej leczenie przy użyciu jodu promieniotwórczego.
Należy nadmienić, że istnieje wiele możliwości kontaminacji jodem: od stosowania różnych leków (np. wykrztuśnych), soli, kropli do oczu zawierających jodek sodu/potasu, czy nawet jodyny (jod wchłania się przez skórę), aż po związki organiczne, które w niewielkim stopniu odszczepiają jod (jodowe środki kontrastowe!). Te ostatnie związki wykazuję się dość wieloma działaniami ubocznymi (mogą uszkadzać m.in. nerki), tarczyca jest jednak potencjalnie najbardziej narażona.
 |
 |
 |
 |
||
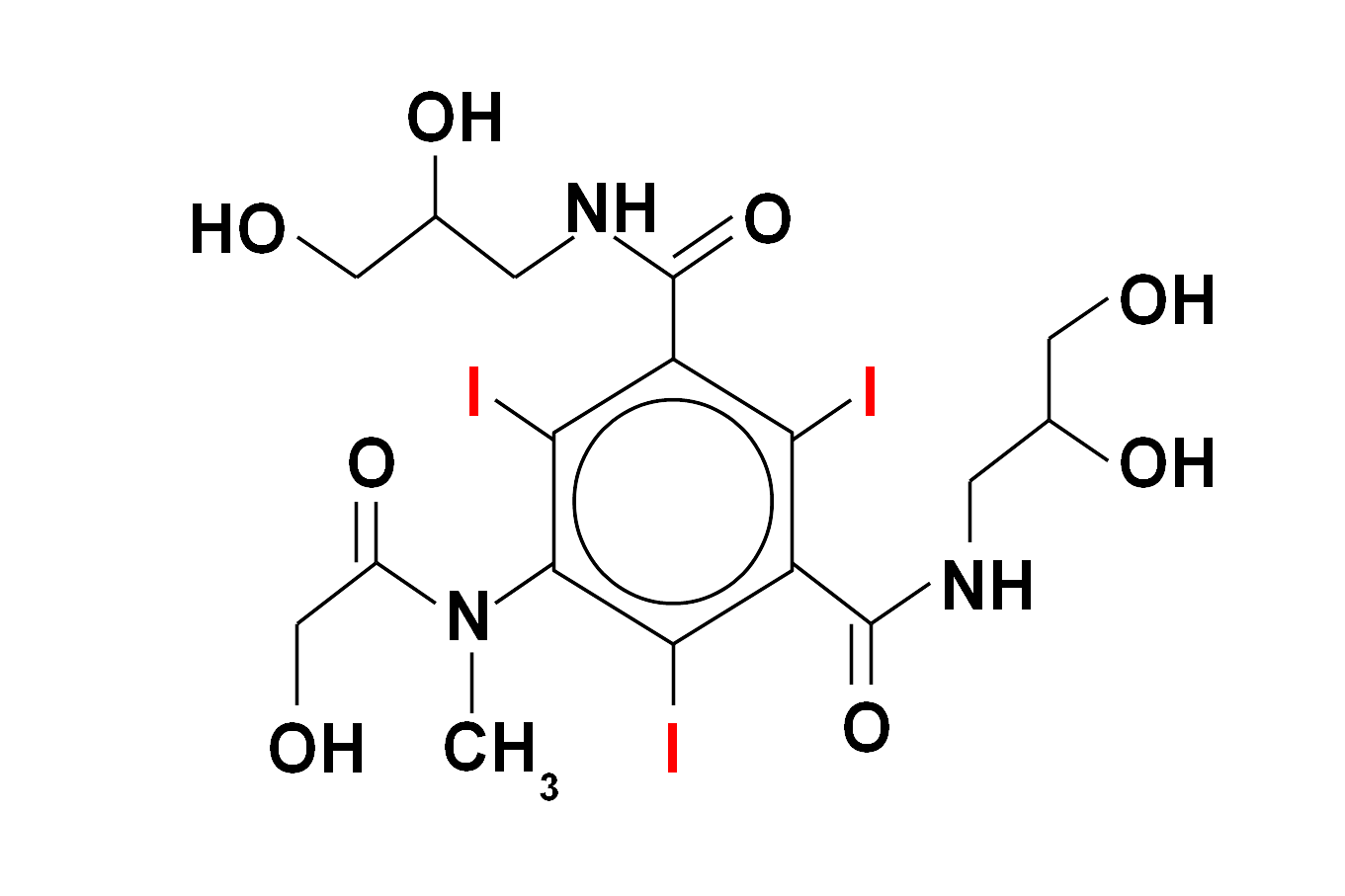
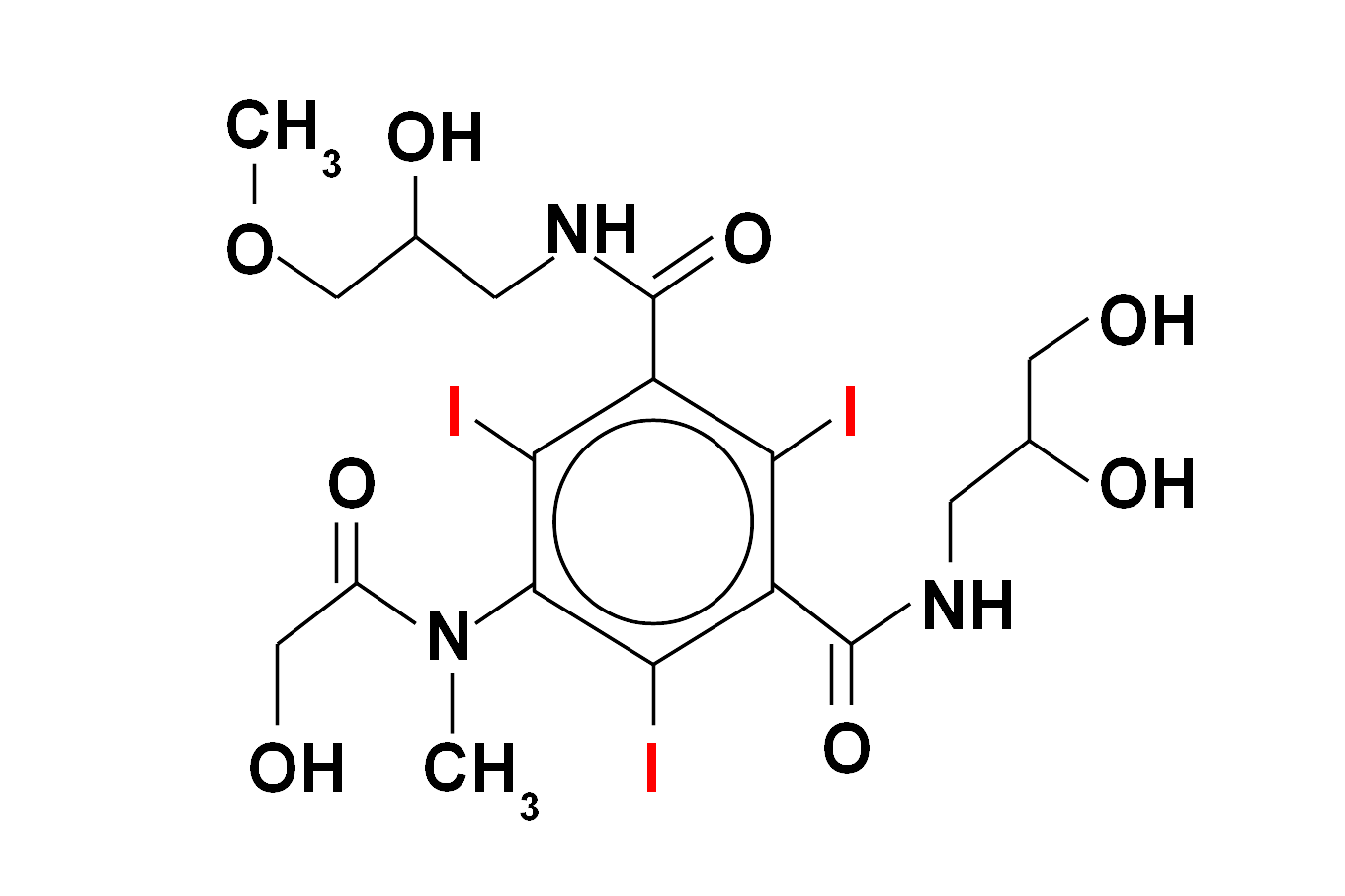
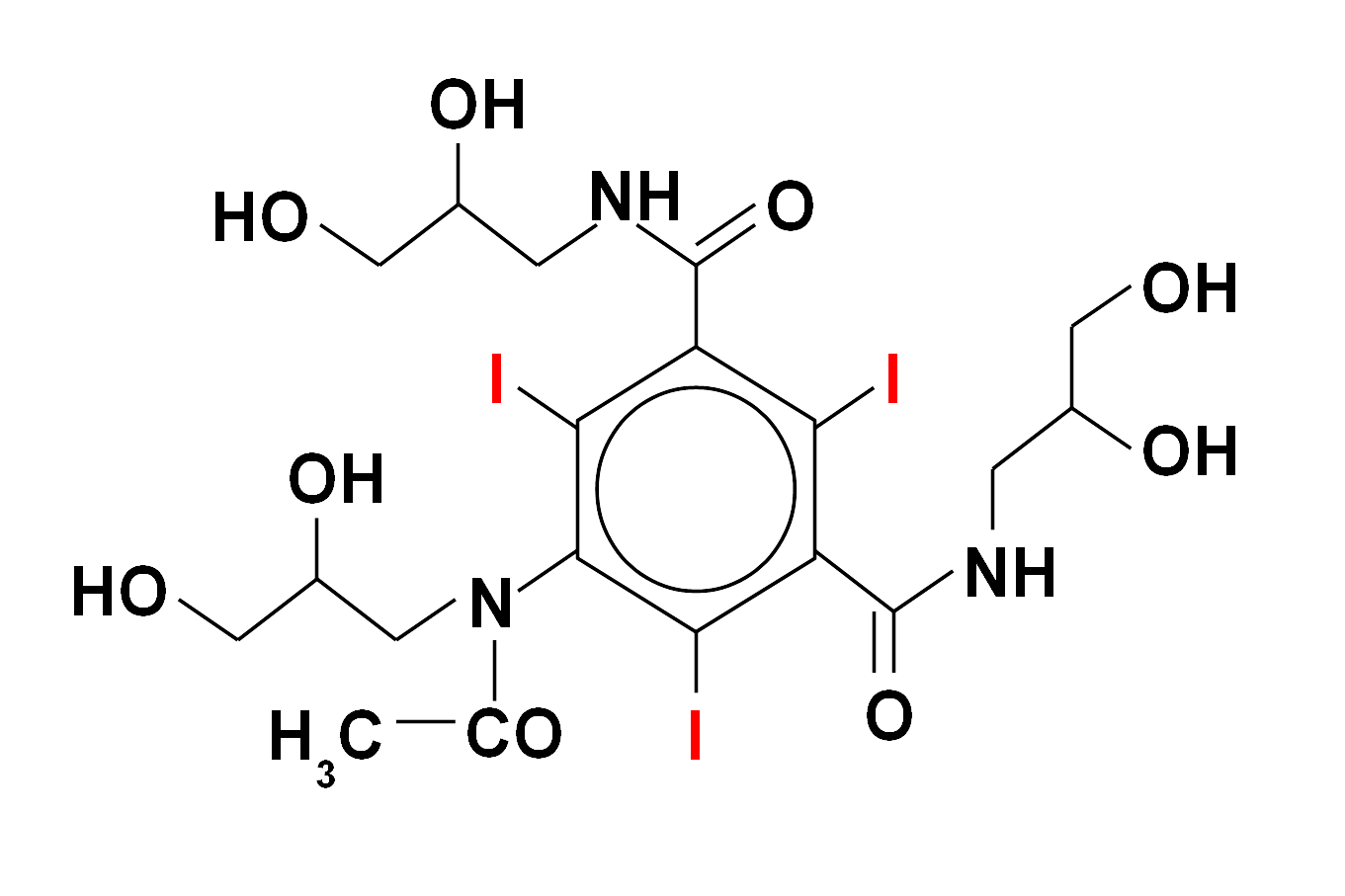
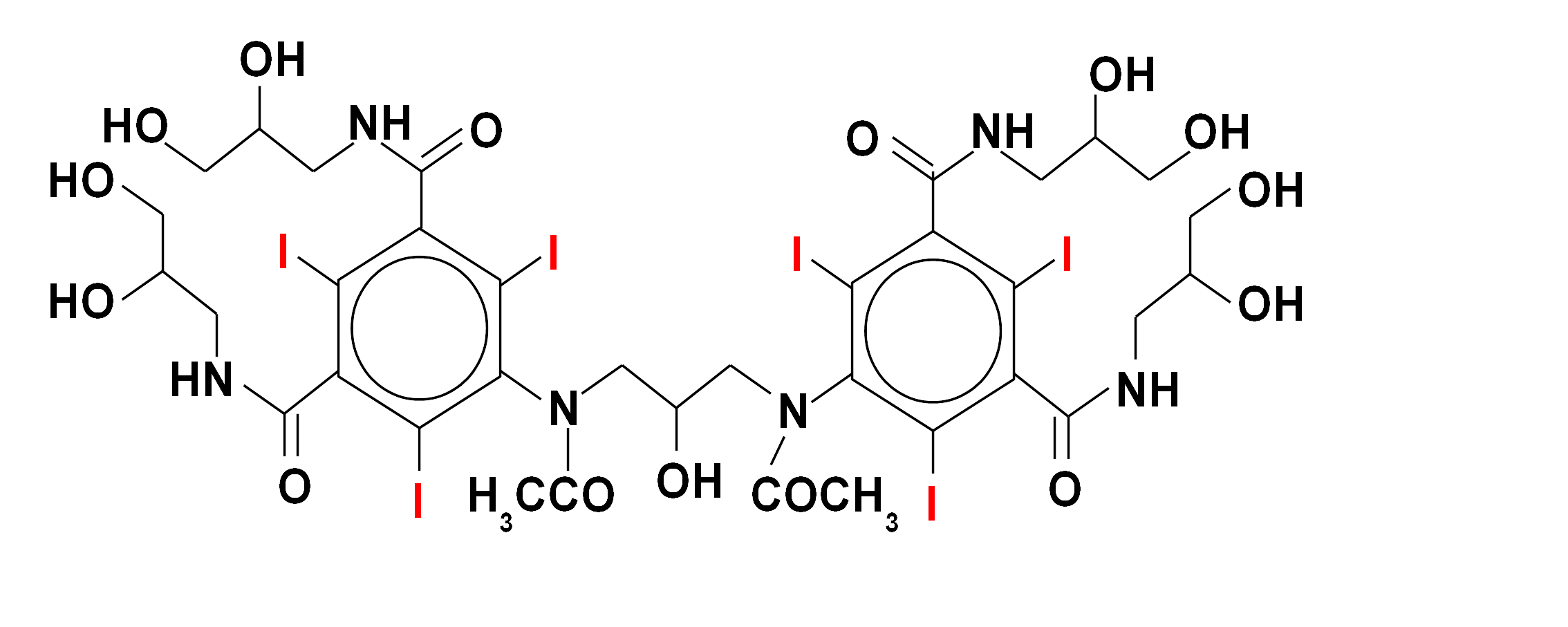
Wśród substancji zawierających jod szczególne miejsce zajmuje lek antyarytmiczny amiodaron (Cordarone, Cordarex), który dodatkowo posiada pewne strukturalne podobieństwo do hormonów tarczycowych. Poprzez długi czas eliminacji z organizmu (lipofilność) może on spowodować u osób predysponowanych długotwałą, trudną do leczenia nadczynność tarczycy, która u pacjentów obciążonych kardiologicznie może mieć szczególnie niebezpieczne konsekwencje. Nadczynność może powstawać w mechanizmie niekontrolowanej produkcji hormonów w tarczycy w warunkach nadmiernej podaży jodu, ale także niszczenia (autoimmunologicznego?) miąższu tego narządu i wtórnego gwałtownego uwalniania hormonów już wcześniej wytworzonych. Rzadziej obserwuje się niedoczynność gruczołu tarczowego u chorych leczonych amiodaronem. Oczywiście możliwa jest także cała gama pozatarczycowych działań ubocznych tego leku.
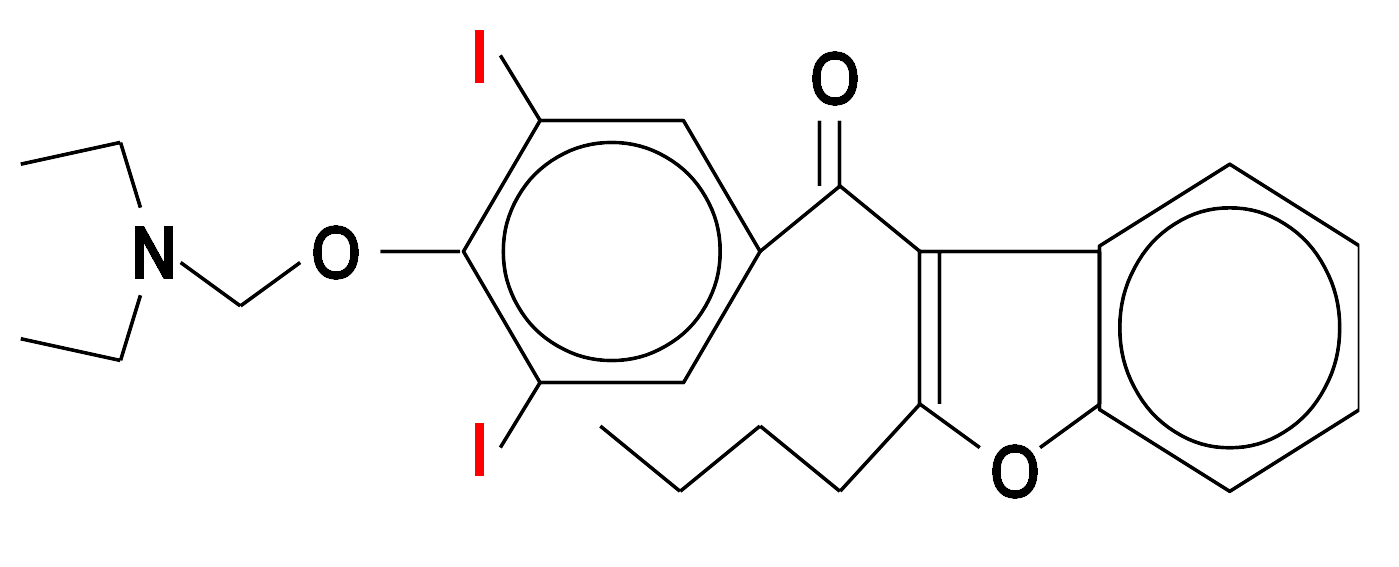
Budowa chemiczna amiodaronu (Cordaron, Cordarex) - ważnego leku antyarytmicznego (stosowanego przez kardiologów w niektórych zaburzeniach rytmu serca). Zawiera on znaczną ilość jodu (wagowo ok. 39 %). Ta właściwość oraz strukturalne podobieństwo do hormonów tarczycy sprawiają, że zaburzenia czynności tego narządu są częstym powikłaniem stosowania amiodaronu. Kumulacja w organizmie warunkuje utrzymywanie się niekorzystnego efektu przez wiele miesięcy po odstawieniu leku.
Leki tarczycowe
Ponieważ zarówno niedobór jak i nadmiar hormonów tarczycowych powodują poważne zaburzenia, oba te stany wymagają leczenia. Niedobór (niedoczynność) leczy się poprzez suplementację (uzupełnianie) hormonami doustnie. Zazwyczaj podaje się preparaty tyroksyny. Trójjodotyroninę stosuje się rzadko.
Nadczynność tarczycy jest stanem bardziej zagrażającym pacjentowi i trudniejszym w leczeniu. Ze względu na długi okres połowicznego zaniku hormonów tarczycy (zwłaszcza T4) we krwi na wymierne efekty (ustąpienie nadczynności) trzeba czekać dość długo. Istnieje kilka możliwości spowolnienia tworzenia hormonów tarczycy. Nadchloran sodu (NaClO4, Irenat) jest względnie bezpieczną substancją blokującą wychwyt jodu przez tarczycę (blokowanie NIS). Niestety, w Polsce jest on słabo dostępny. Methimazol (Thiamazole, Tapazole, Methizol) należy do grupy tionamidów, blokuje działanie peroksydazy tarczycowej (i w konsekwencji wbudowywania jodu do tyreoglobuliny). Lek ten posiada jednak liczne działania uboczne (uszkadzanie wątroby, szpiku, reakcje alergiczne). Poza tym jego działanie jest osłabione w sytuacji kontaminacji jodem. Pre-lekiem methimazolu (pro-drug, ulega w wątrobie przemianie do methimazolu) jest rzadko stosowany karbimazol. Propylthiouracil (Propylotiouracyl, Propycil, Thyrosan) jest lekiem o podobnym mechanizmie działania na peroksydazę. Poza tym wykazuje on również działanie blokujące na enzym 5'-dejodynazę tyroksyny (spowalnia konwersję T4 do bardziej aktywnego T3). Charakteryzuje się krótszym niż methimazol działaniem. Możliwe efekty uboczne są, podobnie jak w przypadku methimazolu, bardzo liczne. Lekami często stosowanymi w leczeniu nadczynności tarczycy, poza powyższymi t.zw. "lekami przeciwtarczycowymi", są β-blokery (substancje blokujące receptory β-adrenergiczne). Wśród nich ważne miejsce zajmuje propranolol, który wykazuje także aktywność blokującą obwodową konwersję T4 do T3.
 |
 |
 |
 |
Niestety, czasami działania uboczne powyższych leków są na tyle istotne, że terapia z ich użyciem nie może być prowadzona. W takich sytuacjach można leczyć węglanem litu (Li2CO3). Lit, regulując działanie licznych kinaz białkowych i systemów sygnałowych (glycogen synthase kinase 3β, protein kinase C, inozytol, cAMP i inne) powoduje między innymi spowolnienie uwalniania hormonów z tarczycy (wydłuża czas ich pobytu w narządzie). Czasami blokowanie uwalniania hormonów nie jest możliwe i jedynym wyjściem jest chirurgiczne usunięcie narządu. Niektóre rodzaje terapii, jak T4/T3-afereza (usunięcie krążących hormonów z krwi), mają na razie znaczenie głównie eksperymentalne.
Wole
Definicja
Wolem (łac.: struma, ang.: goiter) nazywamy powiększenie objętości gruczołu tarczowego ponad umownie przyjętą normę. Wynosi ona
Przyczyny
Czynnikami predysponującymi do powstania wola u większości pacjentów są skłonności genetyczne oraz niedobór jodu. Ten ostatni poprzez zmniejszenie wytwarzania związków jodu w tarczycy (zarówno związków jodolipidowych, jak i właściwych hormonów tarczycowych
Istnieją również rzadkie formy wola spowodowane ściśle określonymi defektami genetycznymi. W takich sytuacjach objawy kliniczne (i/lub zaburzenia laboratoryjne) ujawniają się zazwyczaj już w dzieciństwie.
Skutki
Wole nieleczone powiększa się i może spowodować problemy natury mechanicznej (np. ucisk na tchawicę - rozmiękanie tchawicy i duszność). Poza tym wolu bardzo często towarzyszy autonomizowanie się części tarczycy, co grozi nadczynnością (spontaniczną lub spowodowaną np. przez kontaminację jodem). Należy również pamiętać, że wśród guzków mogą ukrywać się obszary zmienione złośliwie (rak).
Leczenie
Terapia w pierwszej kolejności obejmuje diagnostykę typu wola. Wole olbrzymie oraz podejrzenie raka są zasadniczo wskazaniami do leczenia chirurgicznego. Neleży się liczyć z możliwością wystąpienia niedoczynności tarczycy po operacji, a także, choć w mniejszym stopniu, innych typowych powikłań (np. uszkodzenie nerwu krtaniowego lub przytarczyc).
Po wykluczeniu raka można w wielu przypadkach próbować osiągnąć zmniejszenie wielkości powiększonej tarczycy za pomocą suplementacji jodem oraz hormonami tarczycy.
Miejsce radiojodoterapii jest ograniczone w przypadku wola obojętnego (bez guzków zimnych). Po zmniejszaniu objętości wola za pomocą jodu promieniotwórczego należy się liczyć z dużym ryzykiem niedoczynności. Guzki zimne w ogóle nie nadają się do leczenia radiojodem, ponieważ go nie wychwytują. W przeciwieństwie do nich guzki ciepłe (zwłaszcza autonomiczne) reagują na podanie 131I bardzo dobrze.
Autonomia tarczycy
Definicja
Autonomią tarczycy nazywamy stan uniezależnienia się tarczycy lub jej części od regulującego wpływu TSH. W normalnej sytuacji w przypadku nadmiaru hormonów tarczycy dochodzi do zmniejszenia wydzielania TSH przez przysadkę, co powoduje obniżenie produkcji hormonów. W autonomii produkcja jest kontynuowana mimo braku stymulującego działania TSH.
Przyczyny
Za bezpośredni powód autonomizowania się tkanki tarczycowej uważane są mutacje (somatyczne) genów kodujących receptor dla TSH (TSH-R) lub białko G odpowiedzialne za przekazywanie sygnału od receptora TSH do wnętrza tyreocytu. Taka mutacja wprawia komórkę tarczycy w stan "ciągłej aktywacji" - nawet w sytuacji znacznie obniżonego poziomu TSH.
Pojedyncze zautonomizowane tyreocyty nie mają niebezpiecznego wpływu na organizm. W niektórych jednak sytuacjach, zwłaszcza zaś
Postacie
Wyróżniamy zasadniczo następujące formy autonomii tarczycy:
1. Autonomia jednoogniskowa (UFA, ang.: unifocal autonomy): nadczynna (gromadząca nadmierną ilość jodu i produkująca nadmierną ilość hormonów) tkanka wzrasta tworząc jeden guzek, zazwyczaj dobrze widoczny w badaniu USG i scyntygraficznym.
2. Autonomia wieloogniskowa (MFA, ang.: multifocal autonomy): nadczynna tkanka zgromadzona jest w więcej niż jednym guzku. Guzki te mogą być bardzo dobrze odgraniczone w badaniu USG oraz dość dobrze w badaniu scyntygraficznym.
3. Autonomia rozsiana (DA, ang.: disseminated autonomy): nadczynne pojedyncze pęcherzyki lub małe grupy pęcherzyków tarczycowych rozsiane są (w miarę równomiernie)
Skutki
Początkowo autonomia tarczycy rozwija się skrycie, objawy narastają powoli i mogą pozostać przez długi okres niezauważone. Z czasem nadmiar hormonów tarczycy staje się biochemicznie (laboratoryjnie) i klinicznie istotny (następuje dekompensacja). Nieleczona autonomia ma przebieg zazwyczaj pogłębiającej się nadczynności.
Szczególnie niebezpieczna może być u takiego pacjenta kontaminacja jodem. Może ona spowodować, że u dotychczas klinicznie zdrowego (nieposiadającego żadnych dolegliwości ze strony tarczycy) człowieka wystąpi zagrażająca życiu nadczynność.
Leczenie
Leki przeciwtarczycowe (obniżające syntezę i wydzielanie hormonów tarczycy) tylko chwilowo łagodzą nadczynność. Nie mogą one jednak spowodować wyleczenia choroby, która zawsze wymaga leczenia definitywnego.
Istnieją dwie metody leczenia definitywnego: operacja oraz radiojodoterapia. Operacja polega na chirurgicznym usunięciu tkanki autonomicznej. Przygotowanie pacjenta polega m.in. na (w miarę możliwości) doprowadzeniu jego tarczycy do normalnej czynności (wyprowadzenie
Przygotowanie do radiojodoterapii w przypadku autonomii jedno- i wieloogniskowej jest zazwyczaj inne. O ile sytuacja kliniczna na to pozwala, staramy się utrzymać TSH pacjenta na możliwie najniższym poziomie. Osiąga się to poprzez odpowiednio niskie dawkowanie leków przeciwtarczycowych, a bezpośrednio przed leczeniem - ich odstawienie. Powoduje to funkcjonalne wyłączenie zdrowej tkanki tarczycy, która dzięki temu nie pochłonie zbyt dużej ilości jodu promieniotwórczego. Niezależna od TSH tkanka autonomiczna wychwyci ten jod. Jedynym częstym
Choroba Graves-Basedowa
Przyczyny i mechanizm
Choroba Graves-Basedowa (autoimmunotyreopatia typu Graves-Basedowa) jest schorzeniem autoimmunologicznym - to znaczy, że własny układ odpornościowy organizmu rozpoznaje własną tkankę tarczycową (a dokładnie: antygen receptora dla TSH) jako coś obcego i wytwarza przeciw niej przeciwciała. Czynnikami predysponującymi mogą być banalne infekcje wirusowe przy niekorzystnej konstelacji antygenów zgodności tkankowej (asocjacja z HLA-B8 i HLA-DR3). Choroba występuje prawie 10 razy częściej u kobiet, pacjenci nią dotknięci mają wyższą skłonność do zapadania na inne schorzenia o podłożu autoimmunologicznym. Palenie tytoniu wpływa na jej przebieg bardzo niekorzystnie.
Dokładna przyczyna tej choroby i jej mechanizm pozostają nieznane. Wiadomo, że w jej przebiegu wytwarzane są przeciwciała przeciw receptorowi dla TSH (nazywane w skrócie a-TSH-R, TSH-R-Ab lub TRAK), jednak nie zawsze mogą one zostać wykryte. Powodują one stałą aktywację tego receptora oraz w konsekwencji znaczną nadczynność tarczycy.
Rozpoznanie
Choroba Graves-Basedowa charakteryzuje się zazwyczaj dość szybką dynamiką narastania objawów nadczynności tarczycy, co często pozwala
Powikłania
Do najgroźniejszych powikłań tej choroby należy endokrynna orbitopatia. Cechuje się wytrzeszczem oczu. W jej przebiegu może w skrajnych sytuacjach dochodzić do owrzodzeń rogówki i ucisku nerwu wzrokowego, a w konsekwencji do ślepoty. Palenie tytoniu może wywołać lub nasilać objawy endokrynnej orbitopatii.
Leczenie
Leczenie przyczynowe tej choroby, ze względu na nie do końca poznany jej mechanizm, nie jest znane.
Początkowo podjąć można próbę leczenia za pomocą klasycznych leków przeciwtarczycowych (tyreostatyków, patrz wyżej). Jej celem jest doprowadzenie
Przy nieskuteczności leczenia zachowawczego, przy nawrotach nadczynności lub przy nietolerancji tyreostatyków należy wdrożyć leczenie definitywne. Istnieją dwie metody takiego leczenia: operacja oraz radiojodoterapia. Operacja polega na chirurgicznym usunięciu (prawie całej) tkanki tarczycowej. Efektem jest praktycznie zawsze niedoczynność (hipotyreoza), której skutki nie są jednak dla organizmu tak niebezpieczne, jak skutki nadczynności, ponadto jej leczenie jest prostsze. Do innych możliwych powikłań zabiegu operacyjnego należą możliwość uszkodzenia nerwu krtaniowego wstecznego (i w rezultacie chrypka), przytarczyc (i w rezultacie tężyczka) oraz powikłania typowo chirurgiczne i anestezjologiczne.
Leczenie jodem promieniotwórczym nie jest obarczone tak dużym ryzykiem. Niedoczynność po radiojodoterapii jest nieco rzadsza, niż po operacji (w zależności od dawki radiojodu), jednak także jest prawie regułą.
Choroba Hashimoto
Choroba Hashimoto (autoimmunotyreopatia typu Hashimoto) jest, podobnie jak choroba Graves-Basedowa, schorzeniem autoimmunologicznym. Jej istotą jest niszczenie miąższu tarczycy, w procesie tym biorą udział przeciwciała. Często możliwe do wykrycia są tak zwane przeciwciała przeciw antygenowi mikrosomalnemu (tożsamego z TPO) - oznaczane a-TPO (lub MAK), czasem przeciw tyreoglobulinie - oznaczane a-Tg (lub TAK).
Przebieg choroby jest różny, początek zazwyczaj skryty. Zwłaszcza w początkowej fazie może dojść do intensywnego niszczenia narządu, co jest związane z uwalnianiem dużych ilości wytworzonych hormonów (może się pojawić nadczynność). Różnicowanie tej fazy z chorobą Graves-Basedowa może być trudne (scyntygraficznie: w chorobie Hashimoto zmniejszony wychwyt nadtechnecjanu/jodu). Choroba może się sama zatrzymać, ale często przechodzi w niedoczynność tarczycy. Leczenie nie jest znane. W razie pojawienia się niedoczynności stosuje się suplementację hormonalną. Choroba Hashimoto jest związana z nieco wyższym ryzykiem zachorowania na raka tarczycy.
Choroba de Quervain
Podostre zapalenie tarczycy typu de Quervain jest stosunkowo rzadszą chorobą, w której najczęściej dominującym objawem jest ból. Jej przyczyny nie są znane, przypuszczalnie są związane z zakażeniem wirusowym i/lub mechanizmami autoimmunologicznymi. Polega na stopniowym niszczeniu miąższu narządu - uwolnione hormony mogą powodować przejściową nadczynność. Scyntygraficznie obserwuje się zmniejszony wychwyt nadtechnecjanu. Leczenie - przeciwzapalne, czasem operacyjne.
Inne choroby łagodne tarczycy
Choroby zapalne gruczołu tarczowego najczęściej są podobne w przebiegu i charakterze do choroby Hashimoto (może nastąpić remisja, nawet trwała, może natomiast pojawić się niedoczynność). W zależności od róznych czynników możemy mówić na przykład o połogowym zapaleniu tarczycy (pojawia się w okresie poporodowym). Do rzadkich form należy t.zw. "wole drewniane" (choroba Riedla), której cechą charakterystyczną jest zwłóknienie i stwardnienie narządu.
Zaburzenia (laboratoryjne) czynności tarczycy mogą się pojawić także jako skutek poważnych chorób układowych (ciężkie stany zapalne, nowotwory). Leczenie w takich sytuacjach musi być prowadzone bardzo ostrożnie.
Wtórne zaburzenia czynności tarczycy (wtórna nadczynność - spowodowana nadmierną produkcją TSH, lub wtórna niedoczynność spowodowana niewystarczającą produkcją TSH) charakteryzują się w badaniach laboratoryjnych jednocześnie, odpowiednio, wysokimi albo niskimi wartościami zarówno TSH jak i hormonów tarczycy. Występowanie tych chorób, podobnie jak zespołów niedoborów receptorów dla hormonów tarczycy, jest w praktyce bardzo rzadkie.
Choroby złośliwe tarczycy
Najważniejszym złośliwym schorzeniem gruczołu tarczowego jest rak tarczycy. Stanowi on ok. 1 % wszystkich nowotworów złośliwych (jest więc nowotworem stosunkowo rzadkim). Większość przypadków raka tarczycy (2/3-9/10) stanowi rak brodawkowy (łac.: carcinoma papillare), rzadszą formą jest rak pęcherzykowy (łac.: carcinoma folliculare), w kilku procentach obserwuje się raka rdzeniastego (łac.: carcinoma medullare), w około 1 % jest to rak anaplastyczny (łac.: carcinoma anaplasticum).
Rak brodakowy i pęcherzykowy posiadają wiele odmian, charakteryzują się w większości przypadków bardzo powolnym wzrostem i możliwością gromadzenia jodu promieniotwórczego. Leczenie jest na początku chirurgiczne, potem przeprowadza się radiojodoterapię ablacyjną. Rokowanie przy prawidłowo prowadzonym leczeniu jest zazwyczaj bardzo pomyślne.
STRONA GŁÓWNA serwisu MEDYCYNA NUKLEARNA